Hämophilie A und B
Innere Medizin
Inhaltsverzeichnis
Definition
X-chromosomal-rezessiv vererbter Aktivitätsmangel der Gerinnungsfaktoren VIII (Hämophilie A) oder IX (Hämophilie B) mit Blutungserscheinungen unterschiedlichen Ausmaßes. 50 % der Fälle werden X-chromosomal-rezessiv vererbt und 50 % entstehen durch Neumutationen.
Epidemiologie
Die Häufigkeit der Erkrankung beträgt 1 : 10 000 Personen in der Bevölkerung Deutschlands. 80 % der Betroffenen leiden an einer Hämophilie A, 20 % an einer Hämophilie B. Aufgrund des X-chromosomal-rezessiven Erbgangs erkranken Männer (XY), während Frauen (XX) Konduktorinnen sind und nur extrem selten erkranken (Tab. 82.3).
Pathogenese
Bei angeborenem Mangel an Faktor-VIII- oder -IX-Aktivität wird das intrinsische plasmatische Gerinnungssystem vermindert aktiviert. Dies führt zu einer geringeren Aktivierung von Faktor X und Thrombin mit der Folge einer verlangsamten Fibrinbildung. Da Thrombin auch Faktor XIII aktiviert, wird zusätzlich die Quervernetzung von Fibrin gestört. Weiterhin ist Faktor VIII auch für die Kollagenbildung verantwortlich. Daher leiden Hämophiliepatienten an Wundheilungsstörungen.
Klinik
| Merke Klinisch sind beide Formen der Hämophilie nicht zu trennen. Erst durch die Bestimmung der Einzelfaktoren gelingt die Differenzialdiagnose. |
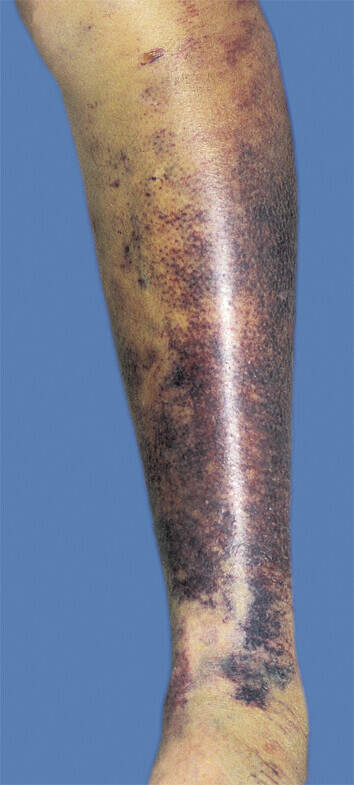
Erste Hinweise auf eine Hämophilie sind ausgedehnte Blutungen bei Bagatelltraumen und kleinen Wunden sowie Einblutungen in Gelenke oder Muskulatur (Abb. 82.3). Ebenso kommt es nach Abrasio und postoperativ zu Nachblutungen. Patienten mit mittelschweren und schweren Formen bluten insbesondere in Gelenke. Die Blutungen treten in diesen Fällen bereits innerhalb des ersten Lebensjahres auf. Diese Patienten erleiden ca. 20–40 Blutungen/Jahr ohne Behandlung.
Bei Patienten mit Subhämophilie und milden Formen der Hämophilie kommt es nur unter Einwirkung von Traumen und bei größeren operativen Eingriffen oder Verletzungen zur Einblutung in Muskulatur oder Gelenke. Die Schweregrade der Hämophilie zeigt Tab. 82.4.
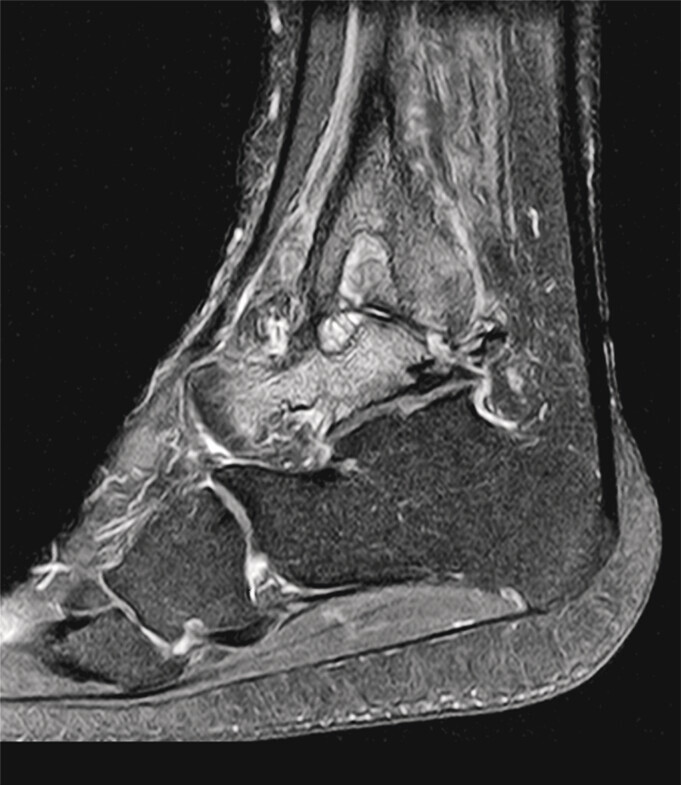
Während Hautblutungen und subkutane Blutungen im Allgemeinen ohne schwerwiegende Auswirkungen sind, führen rezidivierende Gelenkblutungen in mittelgroße Gelenke (Knie-, Ellenbogen-, Sprunggelenk) und Muskelblutungen zu schweren sekundären Schädigungen. Folge sind Muskelatrophien, Kontrakturen, Schädigungen des Bandapparates, chronische Synovitis und schließlich Schädigungen der Gelenke bis zu Gelenkversteifungen. Retroperitoneale Blutungen sind wegen der geringen Symptomatik schwer zu diagnostizieren. Erst massive Einblutungen weisen eine entsprechende Klinik auf. Resorptionsfieber bei retroperitonealen Blutungen führt zur Differenzialdiagnose Appendizitis oder akutes Abdomen. Intrakraniale Blutungen sind bei 25 % der Patienten die Todesursache.
Diagnostik
Spontane Hämatome bei Männern und eine positive Familienanamnese sowie eine verlängerte aPTT sind richtungsweisend. Die Thrombozytenfunktion, Blutungszeit, Faktor-VIII-assoziiertes Antigen und vWF sind normal. Die Diagnosestellung erfolgt durch die Bestimmung der Faktor-VIII- und Faktor-IX-Aktivität (DD Hämophilie A bzw. B). Anschließend ist ein kompletter Gerinnungs- und Thrombozytenstatus zur Erfassung der Funktion der gesamten Hämostase erforderlich.
Therapie
Eine Substitution mit Faktorenkonzentrat ist die erste Therapiemaßnahme. Alle schweren Formen der Hämophilie erfordern eine kontinuierliche Substitution mit Faktor-VIII- oder -IX-Konzentrat. Im Rahmen der Akuttherapie ist bei Blutungen die sofortige i. v. Gabe von 25–50 I.E./kg KG indiziert sowie ggf. eine sorgfältige lokale Blutstillung notwendig.
Als Dauerbehandlung werden 25 I.E. Faktor-VIII- oder -IX-Konzentrat/kg KG i. v. verabreicht. Die Gabe erfolgt 3-mal pro Woche bei Hämophilie A und 2-mal pro Woche bei Hämophilie B.
| Merke Intramuskuläre Injektionen und thrombozytenaggregationshemmende Substanzen sind bei unbehandelter Hämophilie kontraindiziert. |
Zur Berechnung der erforderlichen Dosis gilt folgende Faustregel:
| Merke Eine Einheit des Faktor-VIII- oder Faktor-IX-Konzentrates hebt die Aktivität im Blut um 1 % pro kg KG an. Entsprechend berechnet sich die Gesamtmenge, um z. B. einen Wert von 50 oder 70 % der Norm zu erhalten. |
Bei leichten Formen der Hämophilie A ist auch die Gabe von DDAVP (1-Desamino-8-D-Arginin-Vasopressin) indiziert. Bei mittelschwerer Hämophilie ist nur im Bedarfsfall bei Auftreten von Blutungskomplikationen ein Anheben der Gerinnungsfaktoraktivität erforderlich. Bei Operationen oder nach größeren Verletzungen ist bei allen Formen der Hämophilie eine Faktorensubstitution erforderlich (Zielwert: Aktivität von 70 % der Norm). Früher bestanden ein Hepatitis- und HIV-Risiko bei der Therapie mit humanen gereinigten Faktor-VIII- oder -IX-Konzentraten: Eine Risikominimierung erfolgt durch Gabe von virusinaktivierten und hoch gereinigten Faktorenkonzentraten, durch rekombinante Faktorenpräparate kann eine Übertragung ausgeschlossen werden. Eine Therapieoption für die Zukunft ist die Heilung durch somatische Gentherapie.
| Exkurs Substitutionstherapie mit Faktorenkonzentration bzw. gerinnungswirksamen therapeutischen Antikörpern
Eine Erfolgsgeschichte ist die konsequente Weiterentwicklung der Faktorenkonzentrate zur Substitution bei Menschen mit defekten oder fehlenden Gerinnungsfaktoren, z.B. bei Hämophilie. Entsprechend der Halbwertszeit der Medikamente ist eine Applikation regelmäßig im Abstand von Tagen erforderlich. Die Therapie übernehmen im Kleinkindalter die Eltern, ab dem Schulalter erfolgt die Schulung zur Selbstapplikation. Bei der Substitution von Gerinnungsfaktorkonzentraten hat die Weiterentwicklung der rekombinanten Medikamente eine deutliche Verlängerung der Halbwertszeiten bewirkt. Der zugelassene bispezifische Antikörper Emicizumab (ein Faktor-VIII-Mimetikum) wird subkutan im Abstand von Wochen appliziert. |
Prognose
Bei chronisch kranken Patienten stellen die resultierenden Körperbehinderungen ein erhebliches Langzeitproblem dar (s. klinischer Fall). Die Rehabilitation dieser Patienten ist von großer Bedeutung (krankengymnastische Übungen sowie berufliche und familiäre Wiedereingliederung).
| Klinischer Fall Ein 28-jähriger Patient leidet seit seiner Geburt an einer Hämophilie. Während der ersten 16 Jahre kam es gehäuft zu spontanen Gelenkblutungen. Bis zu diesem Zeitpunkt war die Diagnose nicht bekannt, sodass keine spezifische Therapie erfolgte. Die Gelenkblutungen waren jeweils durch Gelenkpunktionen entlastet worden. Aufgrund des chronischen Reizes kam es zu schwersten sekundären arthrotischen Gelenkveränderungen. Nach Diagnosestellung folgte eine regelmäßige Substitution mit Faktor-VIII-Konzentrat, die Dosierung betrug 3-mal wöchentlich 2000 I.E. i. v. Der Patient führt die Verabreichungen selbst durch. Gelenkblutungen traten seitdem nicht mehr auf. Die chronischen Schäden sind jedoch teilweise irreversibel. |
Abb. 82.3 Befunde bei Hämophilie
a Typisches großflächiges Hämatom.
(Quelle: Studt J, Bächli E. Hämorrhagische Diathesen. In: Battegay E, Hrsg. Differenzialdiagnose Innerer Krankheiten. Stuttgart: Thieme; 2017)
b Fortgeschrittene Gelenkdestruktion bei rezidivierendem Hämarthros.
(Quelle: Vahlensieck M, Sikorski A, Glaser C. Hämophile Osteoarthropathie. In: Vahlensieck M, Reiser M, Hrsg. MRT des Bewegungsapparats. Stuttgart: Thieme; 2014)
Literatur
Quelle
Spannagl M. Hämophilie A und B. In: Arastéh K, Baenkler H, Bieber C, Boesecke C, Brandt R, Bruns B, Bugaj T, Chatterjee T, Ditting T et al., Hrsg. Duale Reihe Innere Medizin. 5., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2024.
eRef-Link: https://eref.thieme.de/127JWXTM