Blutungskrankheiten/Hämophilie
Pädiatrie
Steckbrief
Blutungskrankheiten (hämorrhagische Diathesen) bedingen vermehrte oder verlängerte Blutungen, sie können angeboren oder erworben sein. Ursächlich kommen Störungen im Bereich der Blutplättchen (Thrombozytopenie und Thrombozytopathien), der Blutgefäße (Vasopathien) und des Gerinnungssystems (Koagulopathien) in Betracht. Die Schweregrade sind sehr variabel. Klinisch manifestieren sich Blutungskrankheiten je nach Schwere mit Spontanblutungen und/oder Nachblutungen nach Traumen und Operationen. Die (Familien-)Anamnese hat bei Blutungskrankheiten große Bedeutung. Diagnostisch kommen Globaltests und Spezialuntersuchungen zum Einsatz. Die Therapie orientiert sich an Art und Schweregrad der hämorrhagischen Diathese. In diesem Kapitel werden schwerpunktmäßig die Koagulopathien (Hämophilien) behandelt.
Aktuelles
- Seit dem Jahr 2022 steht für die Behandlung der schweren Form von Hämophilie A eine Gentherapie zur Verfügung; diese ist durch die EMA (European Medicines Agency) auch für die EU zugelassen.
- Der Wirkstoff Roctavian (Valoctogene Roxaparvovec) ist ein AAV-Vektor (nicht vermehrungsfähiges Adeno-assoziiertes Virus), der das fehlende Gen in menschliche Zellen einschleust.
- Zielzellen sind Leberzellen, dort wird die Synthese von Faktor VIII induziert.
- Die Wirkstoffapplikation erfolgt in Form einer einmaligen intravenösen Gabe.
- Die Kosten des Wirkstoffs (Einmalgabe!) liegen derzeit bei mehreren Millionen Euro.
Synonyme
- Blutungsneigung
- hämorrhagische Diathese
- Koagulopathien
- „Bluterkrankheit“
- haemophilia
- bleeding disorders
- coagulopathy
- coagulation disorders
Keywords
- Blutungsneigung
- hämorrhagische Diathese
- Koagulopathien
- Hämophilie
- Faktor VIII
- Faktor IX
Definition
Blutungskrankheiten bedingen pathologisch vermehrte oder verlängerte Blutungen (hämorrhagische Diathese) durch Störungen der Thrombozyten, der Blutgefäße oder der plasmatischen Gerinnung. Letztere werden als Koagulopathie bzw. Hämophilie bezeichnet.
Epidemiologie
Häufigkeit
- Da mehrere Ursachen in Betracht kommen, kann für den Überbegriff „Blutungskrankheiten“ keine allgemeine Häufigkeit angegeben werden.
- Häufigkeiten werden bei den einzelnen Erkrankungen (Thrombozytopenie, Thrombozytopathien, Purpura Schönlein-Henoch etc.) genannt.
- Die häufigste symptomatische (schwere) Koagulopathie ist die Hämophilie A, diese betrifft etwa 1:5000 männliche Neugeborene.
- Wesentlich seltener ist die symptomatische Hämophilie B, diese betrifft etwa 1:25000 männliche Neugeborene.
- Häufiger als Hämophilie A und B ist das Von-Willebrand-(Jürgens-)Syndrom mit einer geschätzten Häufigkeit von 1:125 (für den asymptomatischen Von-Willebrand-Faktor-Mangel), klinisch manifest wird dieses allerdings nur bei etwa 1:8000 Menschen (männliches und weibliches Geschlecht gleichermaßen betroffen).
Altersgipfel
- Die häufigste hämorrhagische Diathese im Kindesalter ist die akute postinfektiöse Immunthrombozytopenie (ITP), sie tritt v.a. im Kleinkind- bzw. Vorschulalter auf.
- Schwere Hämophilien manifestieren sich in der frühen Kindheit, selten jedoch schon in der Neonatalzeit.
- Das Von-Willebrand-(Jürgens-)Syndrom kann sich in jedem Alter manifestieren, bei Mädchen wird die Diagnose oft nach der Menarche gestellt.
Geschlechtsverteilung
- Hämophilie A und B: X-chromosomal-rezessiv, fast nur männliches Geschlecht betroffen
- Die meisten anderen Blutungserkrankungen zeigen keine Geschlechterpräferenzen.
Prädisponierende Faktoren
- männliches Geschlecht (Hämophilie A und B)
- Genetik
- Vitamin-K-Mangel
- Leberzellschädigung, Leberunreife des Frühgeborenen, Malabsorption (z.B. Zöliakie), Mukoviszidose, parenterale Ernährung, Cumarinbehandlung
- durchgemachte Infektionen (v.a. für ITP)
- Medikamente, toxische Substanzen
Ätiologie und Pathogenese
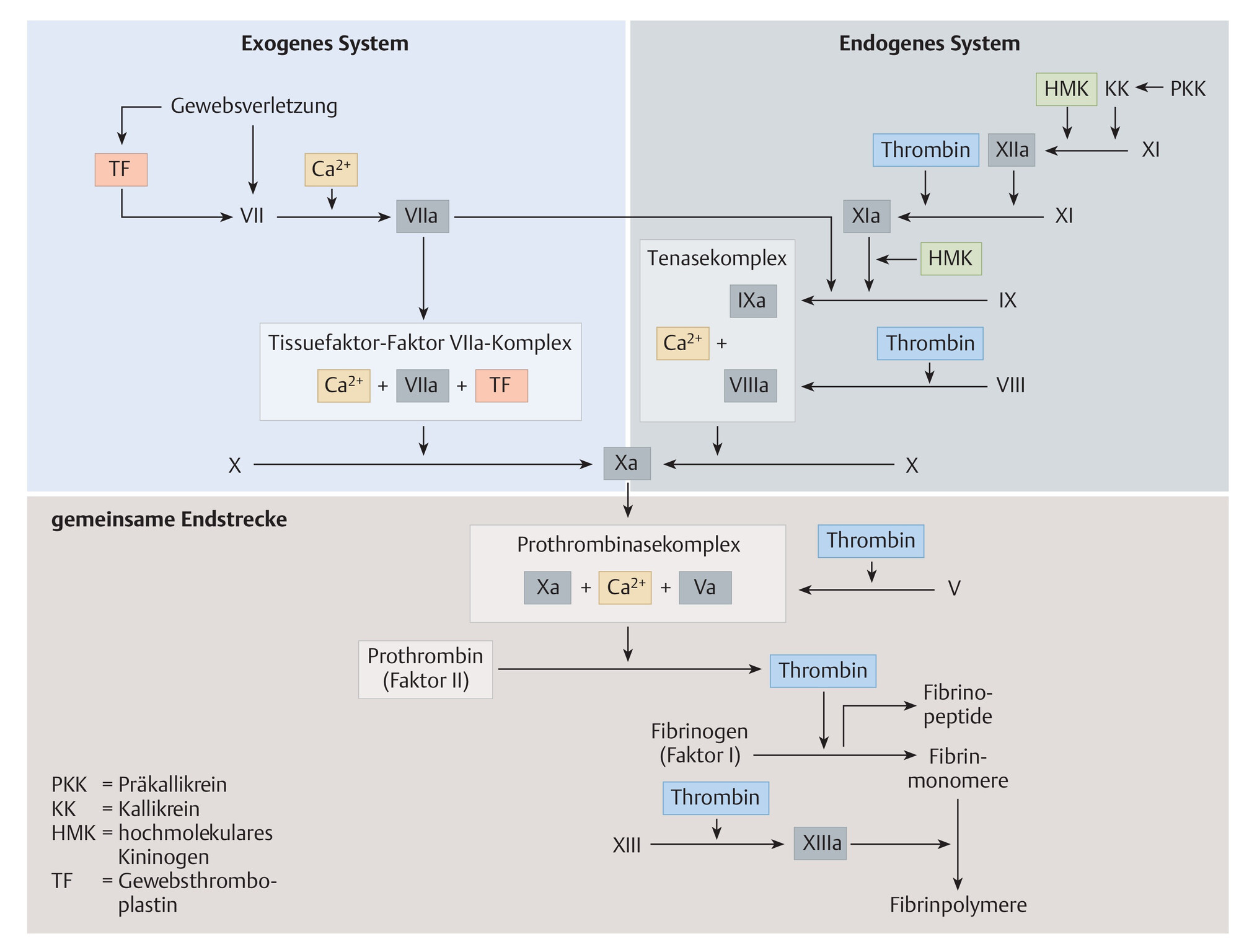
- Ablauf der Blutgerinnung s. Abb. 506.1 (Die Unterteilung der Blutgerinnungs-„Vorphase“ in ein exogenes/extrinsisches und ein endogenes/intrinsisches System wird heute vielfach als veraltet angesehen. Sie wird trotzdem hier in der Abbildung (noch) abgebildet, weil sie sich in vielen Quellen noch in dieser Form findet und sie einen guten Überblick über die einzelnen Gerinnungsfaktoren und deren Zusammenwirken gibt.)
- klinische Differenzierung der Blutungskrankheiten s. Tab. 506.1
Angeborene Blutungserkrankungen
- Hämophilie A:
- Faktor VIII ↓
- X-chromosomal-rezessiv
- Prothrombinzeit (PZ) normal, partielle Thromboplastinzeit (PTT) ↑
- häufigste Form der Hämophilie
- Hämophilie B:
- Faktor IX ↓
- X-chromosomal-rezessiv
- PZ normal, PTT ↑
- Hämophilie C (Rosenthal-Syndrom):
- Faktor XI ↓
- autosomal-rezessiv
- PZ normal, PTT ↑
- Blutungsneigung korreliert wenig mit Faktor-XI-Spiegel
- kongenitale Hypofibrinogenämie/Afibrinogenämie:
- sehr selten
- Faktor I (Fibrinogen) ↓
- TZ (Thrombinzeit) ↑, PTT ↑
- Faktor-V-Mangel/Parahämophilie (Owren-Syndrom):
- autosomal-rezessiv
- Faktor V ↓
- PZ ↑, PTT ↑
- unterschiedliche Ausprägung
- Manifestation in jedem Alter möglich
- Faktor-VII-Mangel (Prokonvertinmangel):
- sehr selten
- autosomal-rezessiv oder autosomal-dominant
- PZ ↑, PTT normal
- Faktor-X-Mangel (Stuart-Prower):
- autosomal-rezessiv
- selten
- unterschiedliche Ausprägung
- PZ ↑
- Manifestation in jedem Alter
- Faktor-XI-Mangel:
- autosomal-rezessiv oder autosomal-(ko)dominant
- meist keine Spontanblutungen
- leichte Blutungssymptome meist nur bei Traumen und/oder Operationen
- PZ normal, PTT ↑
- Faktor-XII-Mangel (Hagemann-Faktor):
- autosomal-rezessiv
- PZ normal, PTT ↑
- keine vermehrte Blutungsneigung
- Faktor-XIII-Mangel (fibrinstabilisierender Faktor):
- Neigung zu spontanen Fehlgeburten
- schlechte Wundheilung
- Globaltests zur Diagnostik nicht geeignet (PZ und PTT normal)
- Von-Willebrand-(Jürgens-)Erkrankung (s. entsprechendes Kapitel)
- erbliche Thrombozytopenie/Thrombozytopathie (s. entsprechende Kapitel)
- Vasopathien:
- Morbus Rendu-Osler: Gefäßwandschwäche mit Verlust der elastischen Fasern
- Von-Hippel-Lindau-Syndrom:
- autosomal-dominant
- Angiome auf/in Netzhaut, Kleinhirn, Rückenmark, Niere, Nebenniere, Bauchspeicheldrüse
- Zysten häufig in Niere und Bauchspeicheldrüse
- Ehlers-Danlos-Syndrom:
- Kollagenstörung mit Überdehnbarkeit von Muskeln, Gelenken, Bändern, Gefäßen, inneren Organen
- vermehrte Gefäßbrüchigkeit (Aneurysmen, Aortendissektion)
Erworbene Blutungserkrankungen
- erworbener Mangel einzelner Faktoren (z.B. Faktor X)
- Antikörper können gegen jeden Einzelfaktor entstehen.
- Der Mangel einzelner Gerinnungsfaktoren kann in unterschiedlichen Kombinationen auftreten (z.B. bei Antikörperbildung, Vitamin-K-Mangel, Cumaringabe, Lebersynthesestörung).
- erworbenes Von-Willebrand-Syndrom (s. entsprechendes Kapitel)
- Verlust-/Verdünnungskoagulopathie: Einsatz von Volumenersatzmitteln bei starken Blutungen (HES, Gelatine, Kristalloide, Albumine) mit Verdünnungseffekt der Gerinnungsfaktoren
- Verbrauchskoagulopathie (DIC = disseminierte intravasale Koagulopathie, s. entsprechendes Kapitel)
- akute postinfektiöse ITP und erworbene Thrombozytopathien (s. entsprechende Kapitel)
- Vasopathien
- Gefäßentzündungen (v.a. Purpura Schönlein-Hennoch)
- Vitamin-C-Mangel (Skorbut) u.a.
| Merke Thrombozytopenien, Thrombozytopathien und Vasopathien (Vaskulitiden) manifestieren sich v.a. anfangs als punktförmige petechiale Blutungen, während Koagulopathien bevorzugt flächig (Suffusionen, Sugillationen) auftreten. |
|
kleine bis mittelgroße Hautblutungen (Petechien und Ekchymosen) |
||
|
Vasopathien (v.a. Vaskulitis) |
vorwiegend kleine Hautblutungen (Petechien) lageabhängig (v.a. untere Extremitäten, seltener Schleimhautblutungen) |
|
Abb. 506.1 Ablauf der Blutgerinnung.
Der initiale Reiz zur Aktivierung des extrinsischen Systems erfolgt durch eine Gefäßverletzung. Große Bedeutung kommt hierbei dem in zahlreichen Geweben vorhandenen Gewebethromboplastin (F III) zu. Durch eine Gewebeverletzung wird F III freigesetzt, dadurch kann F VII an Gewebethromboplastin binden und wird zu F VIIa aktiviert. Der Proteinkomplex aus Gewebethromboplastin und F VIIa bewirkt wiederum eine Aktivierung von F X zu F Xa. Der Komplex aus F Xa, F Va, Kalzium und Phospholipiden (sogenannter Prothrombinasekomplex) führt zur Umwandlung von Prothrombin in Thrombin. Diese Vorgänge erfolgen Ca2+-vermittelt. Thrombin bewirkt eine Umwandlung von Fibrinogen zu Fibrin. Fibrinmonomere werden durch F XIIIa zu Fibrinpolymeren quervernetzt. Gerinnungsfaktoren: Faktor I = Fibrinogen, Faktor II = Prothrombin, Faktor IIa = Thrombin, Faktor III = Gewebethromboplastin (= „tissue factor“ = TF), Faktor IV = Kalzium, Faktor V = Proaccelerin, Faktor VI = aktivierter Faktor V, Faktor VII = Prokonvertin, Faktor VIII = antihämophiles Globulin A, Faktor IX = antihämophiles Globulin B, Faktor X = Stuart-Prower-Faktor, Faktor XI = Rosenthal-Faktor, Faktor XII = Hageman-Faktor, Faktor XIII = fibrinstabilisierender Faktor.
(Quelle: Spannagl M, Harenberg J. Komponenten und Ablauf. In: Arastéh K, Baenkler H, Bieber C et al., Hrsg. Duale Reihe Innere Medizin. 4., überarbeitete Aufl. Stuttgart: Thieme; 2018.)
Symptomatik
- s. Tab. 506.2
- Manifestation von Blutungskrankheiten ist abhängig von:
- genetisch vs. erworben
- Art der Erkrankung
- Schweregrad
- Exposition
- Alter
- Der „hämophile Blutungstyp“ manifestiert sich v.a. an Haut, Schleimhäuten und Weichteilen, kann aber auch jedes andere Organ(system) betreffen. Latente Blutungsneigung besteht meist (bei Hämophilien) bei Abfall der Einzelfaktoren <40%, manifeste Blutungen meist <10%.
- Die früheste Manifestationsform der Vitamin-K-Mangelblutung besteht in einer schweren Blutungsneigung bereits am 1. Lebenstag, häufig verbunden mit zerebralen Blutungen (evtl. durch maternalen Vitamin-K-Mangel).
- Der Morbus haemorrhagicus neonatorum ist bedingt durch nicht ausreichenden Prothrombinkomplex und tritt bei nicht durchgeführter Vitamin-K-Prophylaxe bei 0,1–1% der Neugeborenen während der ersten 2–5 Lebenstage auf (Nabel- und/oder Schleimhautblutung, flächenhafte Hämatome, Blutungen aus dem Magen-Darm-Trakt/Meläna und aus Punktionsstellen).
- Die späte Form der Vitamin-K-Mangelblutung nach der 1. Lebenswoche bis zu mehreren Wochen postnatal (u.a. mit subduralen, subarachnoidalen und intrazerebralen Blutungen) beruht auf nicht ausreichender oraler Zufuhr (Muttermilch enthält wenig Vitamin K) oder in Verbindung mit einer Vitamin-K-Resorptionsstörung, chronischer Diarrhö, zystischer Fibrose, α1-Antitrypsinmangel, Hepatitiden und Cholestasesyndromen (z.B. Gallengangsatresie).
- Cave: Melaena spuria – Verschlucken mütterlichen Bluts, z.B. aus Rhagaden der Brustwarzen
- Im Unterschied zu Blutungen durch Vitamin-K-Mangel manifestieren sich genetisch bedingte Koagulopathien (z.B. Hämophilie A und B) kaum in den ersten Lebenstagen, sondern je nach Schweregrad erst nach der Neonatalperiode.
- Sonderform Thrombophilie bei Therapie mit Vitamin-K-Antagonisten
- Im Rahmen einer Therapie mit Vitamin-K-Antagonisten kann es bei konstitutionellem Protein-C- oder Protein-S-Mangel zu thrombotischen Ereignissen kommen (Cumarinnekrose mit Bild der Purpura fulminans).
- Ursache ist schnellerer Abfall der Vitamin-K-abhängigen Gerinnungsinhibitoren Protein C und Protein S mit einer daraus resultierenden Verschiebung der Hämostase in Richtung Thrombophilie.
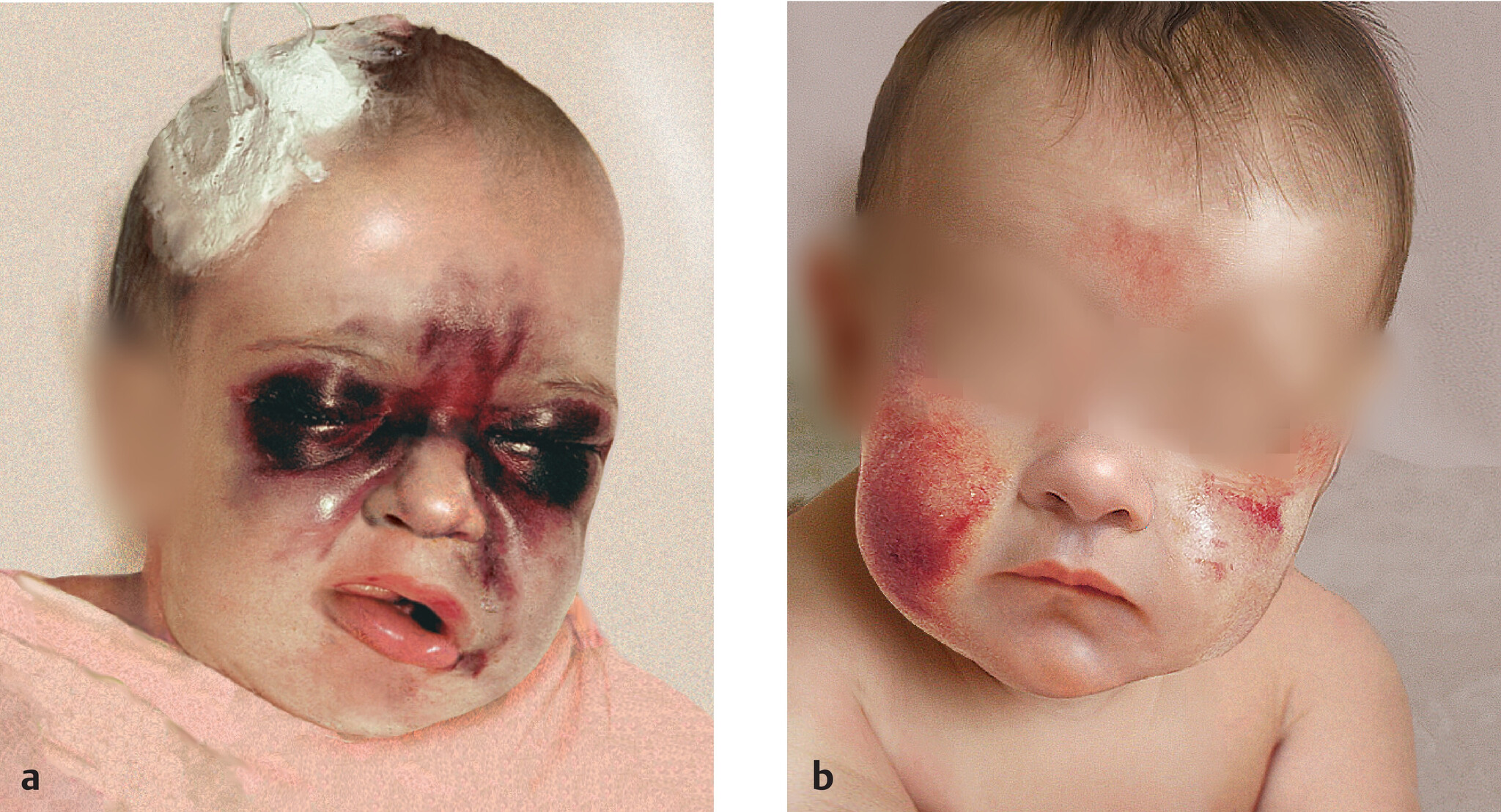
Abb. 506.2 Suffusion bei Hämophilie.
Ausgeprägte Suffusionen bei schwerer Hämophilie A.
a Vor Behandlung mit F-VIII-Konzentrat.
b Nach Behandlung mit F-VIII-Konzentrat.
(Quelle: Muntean E. Hämophilie A. In: Gortner L, Meyer S, Hrsg. Duale Reihe Pädiatrie. 5., vollständig überarbeitete Aufl. Stuttgart: Thieme; 2018.)
Diagnostik
Diagnostisches Vorgehen
- ausführliche Anamnese
- körperliche Untersuchung
- Labor
- ggf. mikrobiologische, bildgebende, instrumentelle und histologische Diagnostik
Anamnese
- Erhebung von Blutungsneigung und zeitlichem Verlauf
- familiäre Disposition
- Menstruationsanamnese
- Vitamin-K-Gaben perinatal
- Vorerkrankungen (v.a. der Leber)
- zurückliegende Infektionen
- Medikamentenanamnese
- Chemo- u./o. Strahlentherapie
- Kontakt mit toxischen Substanzen
- Impfungen
- Tiergifte (Insekten, Spinnen, Schlangen)
- Traumata
Körperliche Untersuchung
- Inspektion von Haut, Schleimhäuten und Weichteilen (Hämatome, Petechien, Ekchymosen, Suffusionen (Abb. 506.2), konjunktivale Blutungen, Nasenbluten, Muskelblutungen)
- neurologische Störungen (ZNS-Blutungen), Meläna, Hämoptoe
- Gelenksblutungen meist nur bei schweren Verlaufsformen
- Blässe bei chronisch-rezidivierenden Blutungen
| Cave Die klinische Präsentation lässt mitunter an Misshandlung denken. Keine vorschnelle Schuldzuweisung vor entsprechender Abklärung (Laboruntersuchungen). |
Labor
- Globaltests (v.a. TZ, PZ und PTT) geben eine Orientierung, ob eine Blutungskrankheit vorliegt (Tab. 506.3). Wenn eine solche vermutet wird, müssen ergänzend die Einzelfaktoren (Faktor V, VII, VIII, IX, X, XII, vWF [Von-Willebrand-Faktor] u.a.) bestimmt werden (Tab. 506.3).
- Thrombinzeit (TZ):
- Zeit von der Zugabe von Thrombin zum Patientenplasma bis zur Umwandlung von Fibrinogen in Fibrin
- Referenzwert 15–35s (laborabhängig)
- verlängert v.a. bei Fibrinogenmangel, Fibrinolysetherapie und Heparingabe
- Prothrombinzeit (PZ):
- beurteilt das exogene System bzw. den „extrinsischen“ Anteil der Blutgerinnung
- Referenzbereich 10–12s
- Aufgrund des relativ schmalen Referenzbereichs wird meist ein Relativwert (Quick in %) angegeben
- verlängert v.a. bei Leberfunktionsstörungen, Vitamin-K-Mangel und Cumarintherapie
- partielle Thromboplastinzeit (PTT):
- beurteilt das endogene System bzw. den „intrinsischen“ Anteil der Blutgerinnung
- Vielfach wird auch die Bezeichnung „aktivierte partielle Thromboplastinzeit (aPPT)“ gewählt.
- Referenzwert 20–40s (laborabhängig)
- Bei Neugeborenen und Säuglingen ist der Wert physiologisch etwas verlängert.
- sonstige Verlängerung bei Hämophilie (A, B, vWF u.a.), Antikoagulation (Heparin, Cumarine), Verbrauchskoagulopathie (DIC), Fibrinogenmangel, „Lupusantikoagulanzien“ (Antiphospholipid-Antikörper der Klassen IgG oder IgM (Ig = Immunglobulin), die Gerinnungstests beeinflussen, aber keine vermehrte Blutungsneigung bedingen)
- Laborbefunde s. Tab. 506.3
|
Blutungszeit ↑ |
||
|
Heparintherapie, Fibrinogen ↓ |
||
|
DIC = disseminierte intravasale Gerinnung (Koagulation), PFA-200 = Platelet Function Analyzer (labormedizinisches Messgerät für orientierende Beurteilung der Thrombozytenfunktion), PTT = partielle Thromboplastinzeit (beurteilt sogenannte „intrinsische“ Blutgerinnung), vWD = Von-Willebrand-Jürgens-Erkrankung (Disease). |
||
| Merke Die Prothrombinzeit wird mit verschiedenen Abkürzungen (PTZ, PZ, Quick) angegeben und auch als Thromboplastinzeit (TPZ) bezeichnet. |
Mikrobiologie
- bei Verdacht auf (post-)infektiöse Ursache für Hämorrhagien
Elektrophorese
-
zur Feststellung eines qualitativen vWF-Mangels
RIPA-Test („Ristocetin-induced platelet aggregation”)
-
Bestimmung der Thrombozytenaggregation
Bildgebende Diagnostik
Sonografie
-
bei Verdacht auf Blutungen (subkutan, Muskel, Gelenke, innere Organe)
CT
-
bei Verdacht auf Blutungen, wenn Sonografie nicht konklusiv
MRT
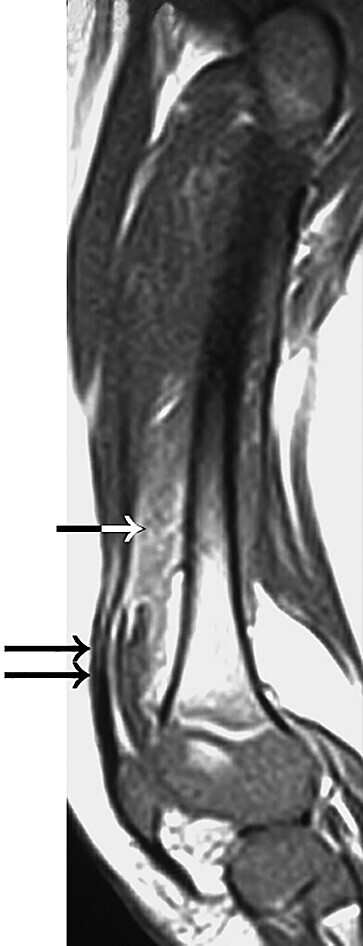
- bei Verdacht auf Blutungen (Abb. 506.3)
- In den meisten Fällen ist allerdings eine (qualitativ hochwertige) Sonografie für eine Beurteilung ausreichend; MRT daher nur bei spezieller Indikation.
Abb. 506.3 Befunde bei Hämophilie.
Intramuskuläres Hämatom (Pfeil) und Hämarthros (Kniegelenk, Doppelpfeil).
(Quelle: Effiziente Kniebildgebung. Mäurer J, Hrsg. 1. Auflage. Stuttgart: Thieme; 2004.)
Instrumentelle Diagnostik
Ösophago-Gastro-Duodenoskopie (ÖGD)
-
bei Verdacht auf gastrointestinale Blutungen
Koloskopie
-
bei Verdacht auf gastrointestinale Blutungen
Rektoskopie/Proktoskopie
-
bei Verdacht auf rektale Blutungen
Bronchoskopie
-
bei (persistierenden) Hämoptysen/Hämoptoe
Ureterozystoskopie
-
evtl. bei unstillbarer/ungeklärter Hämaturie
Histologie, Zytologie und klinische Pathologie
Zervixzytologie
-
ggf. zum Malignomausschluss bei Metrorrhagien/Menorrhagien
Knochenmarkdiagnostik
-
bei Verdacht auf myeloische Genese einer Blutungsstörung
Histologische Leberdiagnostik
-
evtl. Verifizierung der zugrunde liegenden Erkrankung bei hepatischer Gerinnungsstörung (Bsp. Gallengangsatresie)
Differenzialdiagnosen
- s. Tab. 506.4
|
endogen: RR (Krise), starkes Pressen, Husten, Erbrechen exogen: große Tiefen (Tauchen), Beschleunigung in kurzem Zeitraum in Überkopfposition >1,5g (z.B. Achterbahn), Explosionen Manifestation: Petechien, Augenblutungen (v.a. subkonjunktival), Epistaxis, Hämatotympanon u.a. |
|
|
(unbemerkte)Traumen: Golfer-Vaskulitis, Anstrengungs-induzierte Vaskulitis (z.B. nach langen Wanderungen) |
|
|
petechienartige Blutungen; Kontakt mit Tieren (v.a. Hunde, Katzen) |
|
|
Petechien und Hämatome an ungewöhnlichen Stellen bei Verdacht immer auch Skelettröntgen – (ältere) Frakturen? |
|
|
selbst oder durch Angehörige (by proxy) beigebrachte Hämatome und andere Blutungen |
|
|
Epistaxis (Locus Kiesselbachi), hämorrhagischer Insult (bei intrazerebralen Gefäßmalformationen) |
|
|
Endometriose, Polypen, Malignome |
|
|
Aortendissektion, Spontanblutungen aus kleineren Gefäßen |
|
|
Sepsis, septische Embolien |
(zunehmende) akrale Purpura an Fußsohlen und unter den Fingernägeln, u.a. bei Endokarditis durch Staphylococcus aureus |
|
Gefäßwandschädigung mit Hautblutungen v.a. an Oberarmen, Oberschenkeln, Händen |
|
|
ASS und andere Thrombozytenaggregationshemmer, Antikoagulanzien, hepatotoxische Medikamente |
|
|
ASS = Acetylsalicylsäure, RR = Riva-Rocci-Blutdruck. |
|
Therapie
Therapeutisches Vorgehen
-
Das therapeutische Vorgehen orientiert sich an der zugrunde liegenden Ursache.
-
Folgend wird nur auf die häufigsten Erkrankungen eingegangen, für seltene Indikationen s. entsprechende Spezialliteratur.
Allgemeine Maßnahmen
- (lokale) Blutstillung (ggf. auch interventionell bzw. chirurgisch)
- Beobachtung und Dokumentation des Blutungsausmaßes
- Objektivierung mit Laboruntersuchungen (v.a. Blutbild)
- Weglassen auslösender Ursachen (gerinnungshemmende Medikamente)
- Vermeidung zusätzlich blutungsfördernder Medikamente (ASS, NSAR [nichtsteroidales Antirheumatikum] u.a.)
- körperliche Schonung/Bettruhe
Konservative Therapie
- sofern zugänglich lokale Kompression bzw. lokale Tamponade
- Hämostyptika
- Eisbeutel
- Elektrokoagulation
- bei Menorrhagien Ovulationshemmer
Pharmakotherapie
- Ziel:
- bestehende Blutungen stoppen
- Blutungen verhindern (Prophylaxe)
- endogene Synthese von Gerinnungsfaktoren unterstützen (v.a. durch Vitamin-K-Gabe)
- Dabei kann spezifisch der jeweils fehlende Faktor (VIII, IX, vWF, Fibrinogen u.a.) ersetzt werden, in Form von Fresh Frozen Plasma (FFP) ein „Faktorenmix“ verabreicht werden, oder (v.a. bei lebensbedrohlichen Blutungen, z.B. Hirnblutung) der Prothrombinkomplex substituiert werden.
- Die Gaben erfolgen intravenös.
Fresh Frozen Plasma (FFP)
- Gabe bei Störungen der Hämostase infolge (kombinierten) Faktormangels (hepatisch bedingt, starke Blutverluste, Austauschtransfusion, Sepsis, auch DIC!)
- Wirkkontrolle mit Globaltests (TZ, PZ/Quick, PTT)
- Dosierung: 10ml/kg i.v.
Prothrombinkomplex
- enthält die (Vitamin-K-abhängigen) prokoagulatorischen Gerinnungsfaktoren Prothrombin (Faktor II), VII und X
- Enthalten sind auch Protein C und Protein S.
- Verwendung v.a., wenn rasche Blutstillung bzw. operative Intervention angezeigt sind
- auch zur raschen Antagonisierung von Vitamin-K-Antagonisten
- Steuerparameter = INR (International normalized Ratio) bzw. Quick-Wert
- Kontraindikation: Verbrauchskoagulopathie (DIC)
Vitamin K
-
zur Substitution bei Vitamin-K-Mangel, Antagonisierung von Cumarinen, Syntheseförderung der Vitamin-K-abhängigen Einzelfaktoren (II, VII, IX, X)
-
Eine Verbesserung ist allerdings erst nach ca. 24h zu erwarten.
-
Steuerparameter = INR bzw. Quick-Wert
-
Dosierung: bei dringlicher Indikation alters- bzw. gewichtsabhängig 1–10mg i.v. (Richtdosis 0,2mg/kg) mit möglicher Wiederholung i.v. (sonst p.o.)
Antithrombin III
-
bei ausgeprägtem AT-III-Mangel
-
1IE/kg KG i.v. steigert die Plasmaaktivität um 1–2%.
Hämophilie A
-
(repetitive) Substitution von Faktor VIII i.v. bei Blutungen
-
prophylaktische Gaben bei schwerer Hämophilie und/oder gehäuften Blutungen
-
Dosierung und Intervall der prophylaktischen Gaben orientieren sich an der Schwere der Erkrankung (Intervall 2d bis mehrere Wochen).
-
Bei akuter Blutung kann zusätzlich Faktor VII unterstützend gegeben werden.
Hämophilie B
-
(repetitive) Substitution von Faktor VIII i.v. bei Blutungen
-
prophylaktische Gaben bei schwerer Hämophilie und/oder gehäuften Blutungen
-
Dosierung und Intervall der prophylaktischen Gaben orientieren sich an der Schwere der Erkrankung.
Hämophilie C (Rosenthal-Syndrom)
-
kein Faktorenkonzentrat (Faktor XI) vorhanden
-
Fresh Frozen Plasma (FFP) 10ml/kg KG i.v.
Parahämophilie (Owren-Syndrom)
-
Faktor-V-Konzentrate
-
ggf. Prothrombinkomplex bei Quick <30% und Blutungen
-
FFP 10ml/kg KG i.v.
Faktor-VII-Mangel (Prokonvertin)
-
Faktor-VII-Substitution
-
Prothrombinkomplex
-
Fresh Frozen Plasma (FFP) 10ml/kg KG i.v.
Faktor-X-Mangel (Stuart-Prower)
-
Faktor-X-Substitution
-
Prothrombinkomplex
-
Fresh Frozen Plasma (FFP) 10ml/kg KG i.v.
Von-Willebrand-Syndrom
-
s. entsprechendes Kapitel
Thrombozytopenien
-
s. entsprechendes Kapitel
Vasopathien
-
Substitution von Vitamin C bei Mangel, sonst je nach Ursache (z.B. Purpura Schönlein-Henoch)
Verbrauchskoagulopathie (DIC)
-
s. entsprechendes Kapitel
Heparininduzierte Thrombozytopenie
-
Heparingaben stoppen
-
Wechsel auf anderes Antikoagulans
Alle Blutungs-/Gerinnungsstörungen
-
Erythrozytenkonzentrate bei Hb<7
Sonderform Hemmkörper-Hämophilie
-
Diese entsteht durch Antikörper gegen Gerinnungsfaktoren.
-
2 mögliche Formen:
-
Autoantikörper (v.a. im höheren Alter) ohne präexistente Hämophilie
-
Alloantikörper: entwickeln sich unter Therapie mit Faktor VIII (Häufigkeit 20–30%) bzw. IX (Häufigkeit ca. 5%); Faktorensubstitution dadurch weitgehend unwirksam
-
-
Therapeutisch kommen Glukokortikoide und andere Immunsuppressiva in Betracht, außerdem aktivierter rekombinanter Faktor VII (Eptacog alfa, Novoseven) sowie hohe Dosen von Faktor VIII bzw. IX („overboost“).
-
Für Hämophilie A existiert auch eine neuartige Therapieform mit dem monoklonalen Antikörper Emicizumab. Dieser imitiert die Funktion von Faktor VIII, ohne vom Hemmkörper erfasst zu werden.
Nachsorge
- abhängig von Art und Schwere der Grunderkrankung
- Insbesondere bei Hämophilie müssen rezidivierende schwere Blutungen vermieden werden. Dies betrifft v.a. Gelenksblutungen, die in weiterer Folge zu Mobilitätseinschränkung und Invalidität führen können.
- Risikoadaptierte Verlaufskontrollen und zielgerichtete Prävention (u.a. mit prophylaktischer Gabe von Faktorenkonzentraten) sind daher unumgänglich, insbesondere auch bei interventionellen/operativen Maßnahmen.
Verlauf und Prognose
- abhängig von Art und Schwere der Erkrankung sowie Qualität der Betreuung und Prävention
- Bei adäquater Führung kann zumeist eine normale Lebenserwartung erreicht werden, vielfach auch eine annähernd normale Lebensqualität.
Prävention
- Vermeidung von Risikofaktoren (u.a. Risiko- und Kontaktsportarten)
- Vermeidung potenziell blutungsbegünstigender Medikamente (ASS, NSAR u.a.)
- prophylaktische Faktorensubstitution
- sorgfältige Planung von Eingriffen
- Ausstellen und Mitführen eines „Bluterausweises“
| Hinweis Neueste Berechnungen haben ergeben, dass sich die Gentherapie bei Hämophilie trotz der hohen Kosten (>2 Mio. Euro) bei Wegfall nachfolgender Behandlungskosten und Invalidität über die gesamte Lebenszeit amortisiert und somit (auch) ökonomisch sinnvoll ist. |
Literatur
Quellenangaben
- [1] Lackner K, Peetz D. Gerinnung (Hämostase). In: Praktische Labordiagnostik. Berlin: DeGruyter; 2009
Suche in: PubMed Google Scholar
Quelle
Starz I, Kerbl R. Blutungskrankheiten/Hämophilie. In: Kerbl R, Reiter K, Wessel L, Hrsg. Referenz Pädiatrie. Version 1.0. Stuttgart: Thieme; 2024.
eRef-Link: https://eref.thieme.de/11TFM6C8